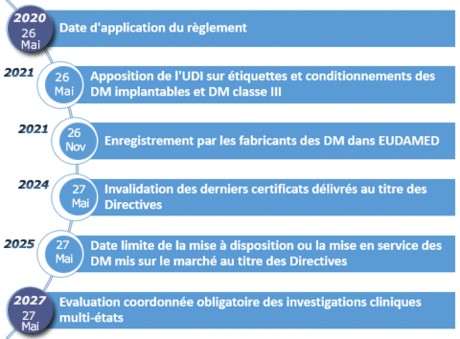
Nouveau règlement spécifique aux dispositifs médicaux (DM) [UE 2017/745].
 |
|
Ainsi, plusieurs directives sont en vigueur en Europe :
- Directive 90/385/CEErelative à la mise sur le marché des dispositifs médicaux implantables actifs
- Directive 93/42/CEErelative à la mise sur le marché des dispositifs médicaux
D'autres dispositions européennes modifiant ces directives sont applicables pour la mise sur le marché européen :
- Directive 2007/47/CEdu 5 septembre 2007 modifiant la directive dispositifs médicaux implantables actifs (90/385/CEE), la directive dispositifs médicaux (93/42/CEE) et la directive mise sur le marché des produits biocides (98/8/CE)
- Directive 2005/50/CErelative aux implants orthopédiques (genou et hanche et épaule)
- Directive 2003/32/CErelative aux dispositifs médicaux fabriqués à partir de tissus d'origine animale
- Directive 2003/12/CErelative aux implants mammaires
- Règlement (CE) no 1882/2003du Parlement européen et du Conseil du 29 septembre 2003 portant adaptation à la décision 1999/468/CE du Conseil des dispositions relatives aux comités assistant la Commission dans l'exercice de ses compétences d'exécution prévues dans des actes soumis à la procédure visée à l'article 251 du traité CE
- Directive 2001/104/CErelative aux dispositifs médicaux contenant des dérivés stables du sang ou du plasma humain (correction de la directive 2000/70/CE)
- Directive 2000/70/CErelative aux dispositifs médicaux contenant des dérivés stables du sang ou du plasma humain
Dispositions françaises
Les directives 90/385/CEE et 93/42/CEE ont été transposées, en droit français, initialement dans le livre V bis du code de la santé publique par :
- La loi n° 94-43du 18 janvier 1994 (articles L.665-1 à L.665-9)
- Le décret n°95-292du 16 mars 1995 (articles R.665-1 à R.665-47)
- Le décret n°96-32du 15 janvier 1996 (articles R.665-48 à R.665-64)
Dans un souci de simplification, le code de la santé publique a été recodifié. Les dispositions applicables aux dispositifs médicaux apparaissent maintenant dans la Cinquième Partie du code de la santé publique – Livre II – Titre Premier.
Cette recodification est intervenue :
- Sur la partie législative du code par l’ordonnance n°2000-548du 15 juin 2000. Les articles L.665-1 et suivants sont désormais numérotés L.5211-1 et suivants,
- Sur la partie réglementaire du code par ledécret n° 2004-802 du 29 juillet 2004. Les articles R.665-1 et suivants sont désormais numérotés R.5211-1 et suivants.
La transposition de la directive 2007/47/CE est intervenue par :
- Le décret n°2010-270 du 15 mars 2010relatif à l'évaluation clinique des dispositifs médicaux et à la communication des données d'identification à l'Agence française de sécurité sanitaire des produits de santé, nouvellement appelée ANSM.
- L’ordonnance n°2010-250 du 11 mars 2010
- Le décret n°2009-482 du 28 avril 2009relatif aux conditions de mise sur le marché des dispositifs médicaux.
Certains articles de la partie réglementaire prévoient la publication d’arrêtés pour préciser leurs modalités d’application.
Arrêtés du ministre chargé de la santé sur proposition du directeur général de l’ANSM :
- Arrêté du 15 mars 2010 modifiant l'arrêté du 20 avril 2006 fixant les règles de classification des dispositifs médicaux, pris en application de l'article R. 5211-7 du code de la santé publique
- Arrêté du 15 mars 2010 fixant les modalités d'application des procédures de certification de la conformité définies aux articles R. 5211-39 à R. 5211-52, pris en application de l'article R. 5211-53 du code de la santé publique
- Arrêté du 15 mars 2010 fixant les modalités d'application des procédures de certification de la conformité définies aux articles R. 5211-39 à R. 5211-52, pris en application de l'article R. 5211-53 du code de la santé publique (rectificatif)
- Arrêté du 15 mars 2010 fixant les conditions de mise en œuvre des exigences essentielles applicables aux dispositifs médicaux, pris en application de l'article R. 5211-24 du code de la santé publique
- Arrêté du 20 avril 2006 précisant la forme et les dimensions du marquage CE devant être apposé sur les dispositifs médicaux avant leur mise sur le marché ainsi que sur leurs emballages commerciaux et leurs notices d’utilisation
- Arrêté du 20 avril 2006 fixant les conditions de mise en œuvre des exigences essentielles applicables aux dispositifs médicaux, pris en application de l'article R. 5211-24 du code de la santé publique
- Arrêté du 20 avril 2006 fixant les règles de classification des dispositifs médicaux pris en application de l'article R.5211-7 du code de la santé publique
- Arrêté du 20 avril 2006 fixant les modalités d'application des procédures de certification de la conformité définies aux articles R.5211-39 à R.5211-52, pris en application de l’article R. 5211-53 du code de la santé publique
- Arrêté du 4 décembre 2006 modifiant l’arrêté du 13 septembre 2005 relatif aux spécifications détaillées précisant les exigences essentielles auxquelles doivent se conformer les dispositifs médicaux fabriqués à partir de tissus d’origine animale
- Arrêté du 13 septembre 2005 relatif aux Spécifications détaillées précisant les exigences essentielles auxquelles doivent se conformer les dispositifs médicaux fabriqués à partir de tissus d'origine animale
- Arrêté du 13 septembre 2005 relatif aux Spécifications détaillées précisant les exigences essentielles auxquelles doivent se conformer les dispositifs médicaux fabriqués à partir de tissus d'origine animale (rectificatif)


